近红外二区多光子荧光成像深层突破深度成像
基于近红外光激发的多光子吸收效应的多光子荧光成像以特有的深穿透、高时空分辨、高信噪比和低毒性等优点,在生物成像,尤其是在活体深层组织成像中被广泛应用。相比传统单光子生物成像中使用的紫外可见光光源,近红外光的引入极大地提高了多光子荧光成像的穿透深度。近些年来,位于近红外二区的光源由于在生物组织中具有更小散射和更大的穿透能力,在单光子和多光子荧光成像中均受到广泛关注和研究,进一步提高了生物成像的深度。

研究背景与技术挑战
荧光显微技术自诞生以来,一直是生物医学研究的核心工具。通过荧光染料标记,科学家得以观察细胞和亚细胞结构的动态。然而,传统单光子荧光成像依赖紫外或可见光作为激发光源,这些波段的光极易被生物组织中的血红蛋白、黑色素等分子吸收,导致穿透深度不足。即便采用最先进的物镜和探测技术,共聚焦显微镜在活体深层组织成像中仍力不从心。这种局限性严重制约了脑科学、肿瘤学等领域对活体动态过程的研究需求。
1990年,Denk等人将多光子吸收效应引入显微成像,发明了双光子激光扫描显微镜,开启了活体深层成像的新纪元。由于近红外光在生物组织中的散射和吸收较低,其穿透深度可达毫米级。更重要的是,多光子激发是一种非线性光学过程,荧光信号仅产生于激光高度聚焦的微小区域,无需针孔即可实现三维层析成像。这一特性不仅简化了光路设计,还大幅降低了光毒性,为长时间活体观测提供了可能。
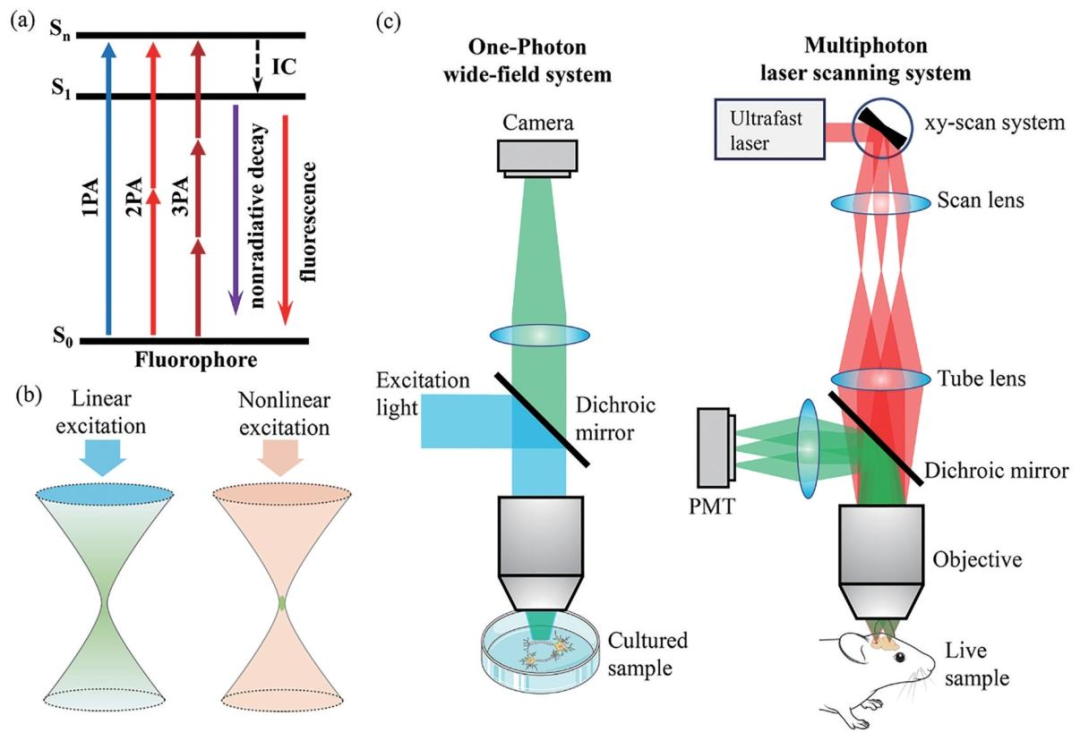
多光子荧光成像原理与系统
近红外光在生物组织成像中具有独特的优势,根据其在组织中的传播特性,可分为近红外一区(NIR-Ⅰ,700-950nm)和近红外二区(NIR-Ⅱ,1000-1700nm)。近红外二区的光在生物组织中具有更小的散射和更大的穿透能力,是更优的“组织光学窗口”,其衰减长度比近红外一区更长,在多光子荧光成像中能够实现更深的成像深度。目前近红外二区激发的多光子荧光成像技术仍面临诸多挑战。现有的具有红光吸收的染料在近红外二区的多光子吸收能力(吸收截面)相对较小,荧光量子产率也较低。此外,许多荧光染料的三光子吸收截面过小,激发效率低,需要更高的激发功率,这又可能导致生物组织的热损伤,在神经元成像中尤为明显。
技术创新与应用
多光子荧光成像基于荧光染料分子吸收多个近红外光子后被激发并发射荧光的原理。在单光子荧光成像中,一个荧光染料分子吸收一个光子从基态激发到激发态,再通过内部转换回到基态并发射荧光,发射光波长大于激发光。而在多光子激发中,染料分子在短时间内吸收两个或三个光子,吸收的光子能量之和接近单光子激发所需能量时,分子也会被激发发射荧光。由于能量关系,多光子激发的光波段红移至近红外波段。
多光子激发是一个非线性过程,双光子吸收激发出的荧光强度与激发光强度的二次方成正比,三光子吸收则与三次方成正比,这种特性使得多光子荧光成像仅在聚焦点处产生荧光,克服了离焦信号的干扰,具备了三维层析成像能力,这是与单光子荧光成像的主要区别之一。
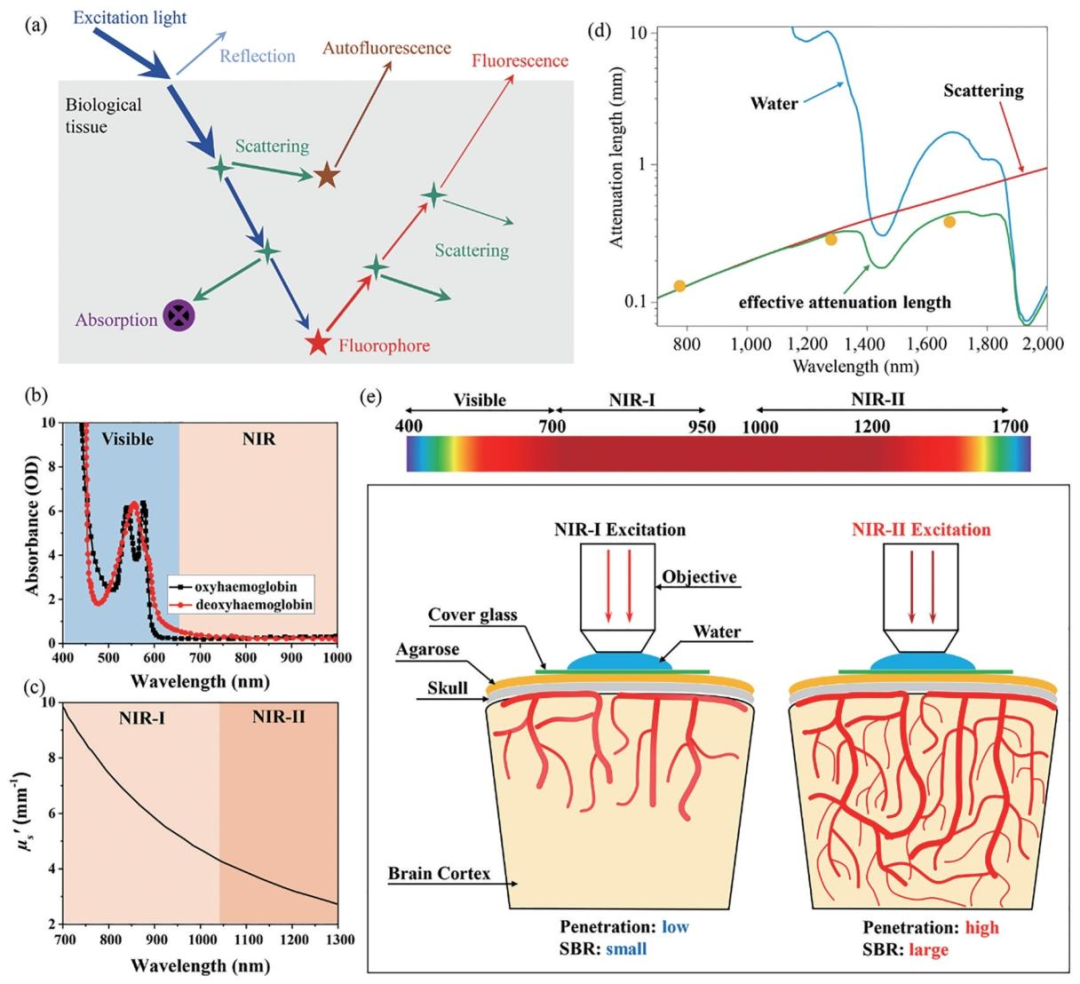
近红外光源在生物组织中的特性
在脑科学研究中,该技术可用于大深度脑血管网络成像和脑神经成像。在脑血管网络成像方面,研究人员利用近红外二区光源激发,成功实现了对小鼠深层脑区微细血管结构的清晰成像。在脑神经成像中,多光子荧光成像技术凭借其细胞级分辨率和活体深脑区三维成像能力,被广泛应用于活体脑神经元的形貌和活动监测。此外,研究人员还通过优化成像系统的光学参数,实现了对深脑区的亚细胞分辨神经功能成像,为脑科学研究提供了有力的技术支持。
在经颅成像研究中,传统的成像在进行脑成像时,需要去除或打磨颅骨,这会对生物组织造成侵入性影响。而近红外二区光源穿透能力更强,有望实现无损的经颅脑成像。Wang团队证明:1320 nm三光子激发可穿透完整颅骨,对皮层下的神经元进行无损成像,还实现了对小鼠脑皮层血管网络的经颅三光子荧光成像,并测试了血流速度,可进一步提高穿透能力和成像深度。
在肿瘤和心血管疾病研究中,多光子成像技术也发挥着重要作用。在肿瘤研究方面,通过标记肿瘤血管或利用肿瘤组织与正常组织内源性荧光团的差异,可实现对肿瘤的高分辨成像。在心血管疾病研究中,脂质在代谢类疾病中扮演着重要角色,但目前在动物活体水平研究脂质的动态发展面临挑战。
成像实验与结果分析
以Kobat等人的实验为例,成功实现了1.6mm深度的小鼠脑活体血管网络双光子荧光成像。在成像过程中,为保证图像信噪比,在脑皮层0.7mm深度以上区域,激发光功率随成像深度增加而逐渐增加。这一实验成果证实了近红外二区光源在深层脑结构多光子荧光成像中的巨大优势。
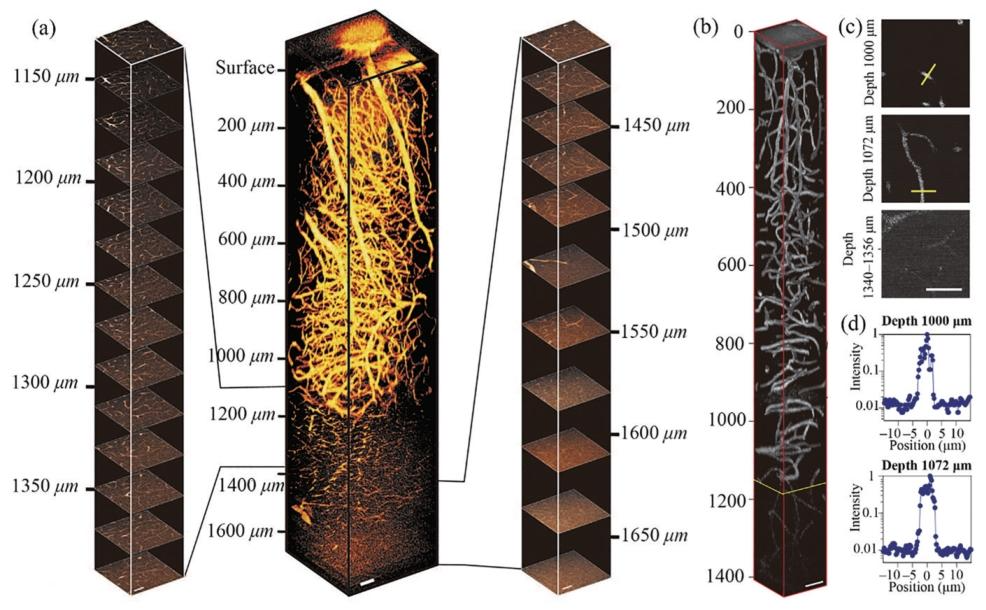
大深度多光子脑血管成像
Horton等人的实验实现了三光子荧光脑成像,成像深度达到1300μm。在成像深度800μm以上区域,每帧图像采集时间约为8s,超过800μm后将激光器功率开到最大,采集时间增加至20s。从实验结果来看,在深度超过1000μm甚至达到1300μm时,脑血管的三光子荧光信号依然能够被采集到并形成图像,在1000-1135μm的脑区,三光子荧光图像的信噪比为79-119。
Liu等人实现了深度达2100μm的脑血管网络三光子成像。量子点具有稳定、荧光光谱窄且明亮的特点,在成像过程中,大深度高速的三光子荧光成像在1700nm激发下能够实现高效的三光子荧光发射。

染料辅助的大深度多光子脑血管成像
Ouzounov等人实现了海马区超过1mm深度的神经元三光子荧光成像。实验结果以高信噪比的三光子荧光图清晰地揭示了在距离大脑表面约1mm位置处的海马区锥体层的神经元的典型蜂窝状排列,同时以8.49Hz的频率记录了约150个神经元的活动,长达48min。
Horton等人实现了三光子荧光成像。这一实验结果表明,虽然1700nm激发下荧光信号较弱,但通过调整积分时间等参数,仍可实现较深的成像深度。Miller等人在整个成像过程中,不同脑区深度采用平均多张图像的方式来保证成像信噪比,随着成像深度增加,荧光蛋白标记的神经元信号逐渐减弱,需要增加成像帧数或提高积分时间,这在一定程度上降低了成像速度。

多光子脑神经成像
Wang等人实验发现,三光子成像后可得到高信噪比的血管图像,920nm激发下的双光子成像,穿过颅骨后的图像对比度非常低,浅层区域未标记区域的背景噪声信号比三光子成像高出数十倍。进一步在1320nm激发下实现双光子荧光成像,但图像对比度有所提升,可能源于长波长减小的散射和像差。研究表明近红外二区长波长激发三光子才能实现高效的经颅成像。当使用1320nm波长光激发三光子时,对经颅后的脑皮层GCaMP6s标记的神经元,最大成像深度可达465μm,可无损地对大脑皮层2/3区域的神经元进行成像,但所需激发光能量高于开颅实验中的双光子成像,这可能会限制经颅三光子成像的最终效果。
Wang等人实现了对小鼠颅骨内骨细胞的三次谐波成像,探测到的颅骨厚度为140μm,颅骨下大脑皮层150μm内的血管和神经元树突也被激发出较强的三次谐波信号。同时,利用染料对颅骨染色后,对颅骨内骨细胞的三次谐波和三光子荧光成像揭示了“三明治”式的结构特征,表明近红外二区光源在脑颅骨中具有较好的穿透能力。

多光子经颅脑成像
在肿瘤方面,Wang等人构建小鼠耳朵皮下肿瘤模型后,能清晰区分正常与肿瘤组织血管。正常组织血管荧光分布均匀、结构平滑有序,肿瘤组织血管扭曲错落,荧光信号分布不均,借此可区分肿瘤边缘。该纳米颗粒体内循环时间长,12小时内可清晰成像,24小时后能观察其在肿瘤内分布。对比近红外一区和二区激发,凸显近红外二区激发在大深度实体肿瘤成像中的优势,为研究纳米药物运输与分布提供方案。
在心血管疾病方面,Wang等人在1200nm激发下,三光子荧光成像实现大深度活体脂质成像,相比双光子成像,信噪比和成像深度更优,证明活体标记脂质的可行性及三光子荧光成像在监测疾病发展中的优势。

肿瘤和心血管疾病多光子荧光成像
总结与展望
在脑科学、肿瘤和心血管疾病研究中提供了关键的成像数据,助力深入探究疾病机制,为诊断和治疗奠定基础。但目前该技术存在荧光染料性能欠佳、激发效率低等问题。为此,科研人员正积极研发新型荧光染料,改进激发光源和成像系统。未来,该技术有望大幅提升成像质量,实现双光子与三光子成像的优势互补,还将与人工智能、光声成像等前沿技术融合,拓展应用边界。
声明:本文仅用作学术目的。
王少伟, 雷铭. 近红外二区激发多光子荧光成像[J]. 激光与光电子学进展, 2022, 59(6): 0617002.
DOI:10.3788/LOP202259.0617002.
关注光量科技
Copyright LogiScience Technology Co.,Ltd 2021. All Rights Reserved.
武汉光量科技有限公司


